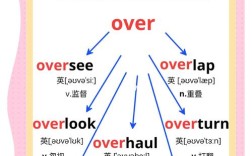
二氧化氯(ClO₂)是一种强氧化性气体,广泛应用于饮用水消毒、食品加工、工业水处理等领域,具有高效、广谱、低残留等优点,由于其化学性质活泼,若操作不当或储存条件不佳,可能导致其分解失效甚至引发安全隐患,以下从化学分解、物理破坏、催化分解及安全防护等方面详细说明如何破坏二氧化氯,同时强调相关操作的规范性和安全性。

化学分解法
二氧化氯的化学分解主要通过还原剂、酸碱反应或氧化还原反应实现,具体方法如下:
还原剂分解
二氧化氯具有强氧化性,易被还原剂还原为氯离子(Cl⁻)或亚氯酸根(ClO₂⁻),常用还原剂包括:
- 亚硫酸钠(Na₂SO₃):在酸性或中性条件下,反应式为:2ClO₂ + Na₂SO₃ + H₂O → 2NaCl + 2HClO₃(或副反应生成NaClO₂),实际操作中,需控制还原剂浓度,避免过量导致残留。
- 硫化钠(Na₂S):反应生成硫单质和氯化物,适用于高浓度二氧化氯的分解,但可能产生硫化氢等有毒气体,需在通风条件下进行。
- 铁盐(如FeSO₄):在酸性环境中,Fe²⁺将ClO₂还原为Cl⁻,自身被氧化为Fe³⁺,反应快速且彻底,常用于应急处理。
酸碱反应分解
- 酸性条件分解:二氧化氯在pH<4的酸性溶液中会歧化生成氯气(Cl₂)和氯酸(HClO₃),反应式为:2ClO₂ + H₂O → Cl₂ + HClO₃ + ½O₂,该方法需严格控制酸浓度,避免产生有毒氯气。
- 碱性条件分解:在pH>10的碱性环境中,二氧化氯歧化为亚氯酸钠(NaClO₂)和氯酸钠(NaClO₃),反应式为:2ClO₂ + 2NaOH → NaClO₂ + NaClO₃ + H₂O,此法分解速率较慢,需长时间搅拌。
有机物反应分解
二氧化氯可与醇类、酚类等有机物发生氧化还原反应,自身被还原,与乙醇反应生成乙醛和氯化物,但有机物分解过程可能产生中间产物,需确保完全反应以避免二次污染。
物理破坏法
物理方法主要通过改变二氧化氯的存在状态或环境条件实现分解:

加热分解
二氧化氯在较高温度下(>40℃)会加速分解,生成氯气和氧气,在50-60℃时,分解半衰期显著缩短,但加热操作需防爆,因二氧化氯气体在空气中爆炸极限为10%-15%(体积分数)。
光照分解
紫外线(UV)或可见光可催化二氧化氯分解,尤其在水溶液中,光照会产生自由基(如·Cl、·OCl),促进分解,实际应用中,可通过增加光照强度或延长照射时间加速反应,但需避免光照过强导致气体逸散。
稀释与通风
通过大量空气或水稀释降低二氧化氯浓度,使其低于安全阈值(如空气中暴露限量为0.3 mg/m³),通风法适用于低浓度泄漏处理,但需结合吸收剂(如活性炭)以防止气体扩散。
催化分解法
催化剂可显著降低二氧化氯的分解活化能,加速反应进程:

- 金属氧化物催化剂:如二氧化锰(MnO₂)、氧化铜(CuO)等,在常温下即可催化ClO₂分解为Cl₂和O₂,MnO₂表面的活性位点可吸附ClO₂分子,促进O-Cl键断裂。
- 活性炭吸附:活性炭不仅物理吸附二氧化氯,还能表面催化其分解,尤其适用于气体净化,但需定期更换吸附剂,避免饱和失效。
安全防护与操作规范
破坏二氧化氯的操作需严格遵守安全规范,避免二次危害:
- 个人防护:操作人员需佩戴防毒面具、橡胶手套和护目镜,在通风橱或密闭系统中进行。
- 应急处理:高浓度泄漏时,优先使用还原剂(如Na₂SO₃溶液)喷洒,再通过通风稀释。
- 废物处理:分解后的废液含氯离子或亚氯酸盐,需中和至中性后,按含氯废水标准处理(如用活性炭吸附或化学沉淀)。
以下为不同分解方法的适用条件对比:
| 分解方法 | 适用场景 | 优点 | 缺点 |
|---|---|---|---|
| 亚硫酸钠还原 | 水溶液中高浓度ClO₂分解 | 反应快速,残留低 | 需控制pH,避免过量还原剂 |
| 酸性歧化 | 酸性废水处理 | 设备简单,成本低 | 产生Cl₂,需尾气吸收 |
| 碱性歧化 | 碱性环境长期储存 | 无毒副产物 | 反应速率慢,需搅拌 |
| 加热分解 | 气态ClO₂处理 | 效率高,适用于工业规模 | 能耗高,需防爆措施 |
| 活性炭催化 | 气体净化低浓度ClO₂ | 操作简便,可重复使用 | 吸附容量有限,需定期更换 |
相关问答FAQs
Q1:二氧化氯泄漏时,如何快速安全地处理?
A1:若发生少量泄漏,立即疏散人员至安全区域,佩戴正压式空气呼吸器,用大量水稀释或用2%亚硫酸钠溶液喷洒吸收;若大量泄漏,需设置警戒区,用防爆风机通风,并联系专业应急队伍处理,避免使用酸性物质以防产生氯气。
Q2:长期储存的二氧化氯溶液如何防止分解失效?
A2:二氧化氯溶液应避光、低温(<10℃)储存,使用稳定剂(如碳酸钠)调节pH至8-10,减少歧化反应;避免与金属离子(如Fe³⁺、Cu²⁺)接触,可选用聚乙烯或玻璃容器,定期检测浓度并补充新鲜溶液。